Desde las cuerdas vocales que producen nuestra voz, a los latidos del corazón, las células de nuestro cuerpo están constantemente sometidas a fuerzas mecánicas que cambian constantemente su respuesta a estos estímulos, regulando procesos esenciales, tanto en individuos sanos, como en condiciones de enfermedad como el cáncer. Sin embargo, y pese a su importancia, seguimos desconociendo en gran medida cómo las células perciben y responden a estas fuerzas.
Ahora, un equipo internacional coliderado por los investigadores Pere Roca-Cusachs, del Instituto de Bioingeniería de Cataluña (IBEC), e Isaac Almendros, del grupo del IDIBAPS Biofísica respiratoria y bioingeniería y del CIBER de Enfermedades Respiratorias (CIBERES), ambos profesores de la Facultad de Medicina y Ciencia de la Salud de la Universidad de Barcelona, acaba de demostrar que lo que determina la sensibilidad mecánica en las células es el ritmo de aplicación de la fuerza, es decir, cuan rápido esa fuerza se aplica. El trabajo se ha publicado en la revista Nature Communications y demuestra, por primera vez in vivo, las predicciones del modelo conocido como “molecular clutch” o “embrague molecular”.
Estos resultados ayudarán, por ejemplo, a entender mejor cómo prolifera un tumor canceroso, pero también a comprender como responde el corazón, las cuerdas vocales o el sistema respiratorio a la constante variación de fuerzas a la que se exponen continuamente.
Un constante “tira y afloja” celular
Los investigadores observaron que hay dos respuestas a la fuerza aplicada sobre una célula, utilizando técnicas punteras como la microscopía de fuerza atómica (AFM) o las llamadas “pinzas ópticas”.
Por un lado, el citoesqueleto, el denso entramado de fibras (principalmente actina), que tiene, entre otras, la función de mantener la forma y estructura de la célula, se refuerza cuando esta es sometida a una fuerza a un ritmo moderado. En este contexto, la célula es capaz de sentir y responder a la fuerza mecánica, y el refuerzo del citoesqueleto lleva a un endurecimiento de la célula, y a la localización de la proteína YAP en el núcleo. Cuando esto ocurre, la proteína YAP controla y activa genes relacionados con el desarrollo del cáncer.
Por otro lado, si el ritmo de aplicación de fuerza sigue aumentando por encima de un determinado valor, se produce un efecto contrario y la célula deja de percibir las fuerzas mecánicas. Es decir, en vez de que el citoesqueleto y la célula sigan aumentando su rigidez, hay una ruptura parcial del citoesqueleto que lleva a un ablandamiento de la célula.
“Como quien estira y encoje un chicle, hemos sometido las células a diferentes fuerzas de forma controlada y precisa, y hemos visto que el ritmo con el que se aplica la fuerza es crucial para determinar la respuesta celular”, explica Ion Andreu, coautor principal del estudio.
Un modelo corroborado con experimentos in vivo
Para entender cómo se relacionan los efectos de refuerzo y ablandamiento del citoesqueleto, los investigadores desarrollaron un modelo computacional que considera el efecto de la aplicación progresiva de fuerza sobre el citoesqueleto y los “enganches” (proteínas que participan en la unión de la célula al sustrato, como la talina y la integrina). Estos “enganches” son de alguna forma análogos al efecto que tiene un embrague de coche de ajustar la conexión mecánica entre el motor y las ruedas, y por ello el modelo se denomina “embrague molecular”.
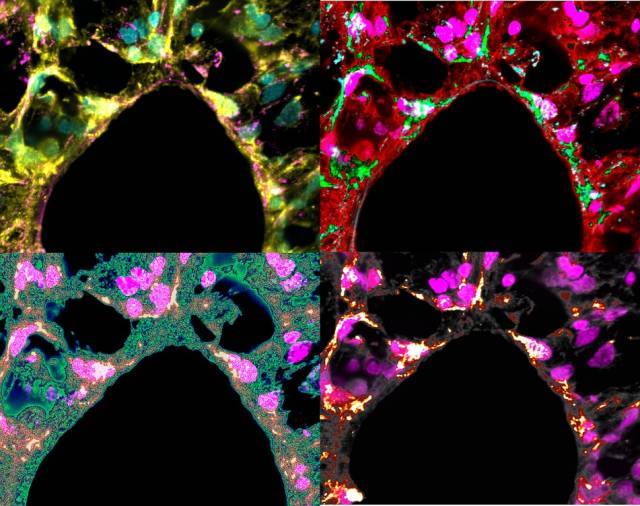
Posteriormente, los científicos realizaron experimentos con ratas de laboratorio para comprobar que los resultados observados en células individuales también ocurren a nivel de órganos enteros in vivo. Para ello, los investigadores se fijaron en los pulmones, que de forma natural experimentan estiramientos mecánicos cíclicos durante la respiración. Concretamente, se ventilaron a ritmos distintos los dos pulmones, de forma que un pulmón se llenaba y vaciaba más rápido (hiperventilación) y el otro más despacio, aunque manteniendo una tasa total de ventilación normal.
Tras analizar y comparar las células de ambos pulmones, observaron que la proteína YAP aumentaba su localización nuclear solamente en las células del pulmón sometido a una hiperventilación. Ese aumento de YAP en muestras vivas, causado por el “tira y afloja celular”, era análogo al que se encuentra en tumores cancerígenos en proliferación.
“Nuestros resultados demuestran, a nivel de órgano, el papel del ritmo de aplicación de la fuerza en la transducción de la señal mecánica inducida por ventilación en los pulmones”, añade Bryan Falcones, coautor principal del estudio.
El trabajo describe un mecanismo por el cual las células responden no solamente a fuerzas directas, sino también a otros estímulos mecánicos pasivos, como la rigidez del sustrato en que se encuentran. Los resultados abren la puerta a entender como fenómenos a priori opuestos, como el refuerzo y el ablandamiento del citoesqueleto, pueden ir de la mano para controlar la mecánica de la célula y responder específicamente a diferentes situaciones.
Artículo de referencia:
The force loading rate drives cell mechanosensing through both reinforcement and cytoskeletal softening
Ion Andreu, Bryan Falcones, Sebastian Hurst, Nimesh Chahare, Xarxa Quiroga, Anabel-Lise Le Roux, Zanetta Kechagia, Amy E. M. Beedle, Alberto Elósegui-Artola, Xavier Trepat, Ramon Farré, Timo Betz, Isaac Almendros & Pere Roca-Cusachs. . Nature Communications, 2021;12:4229.