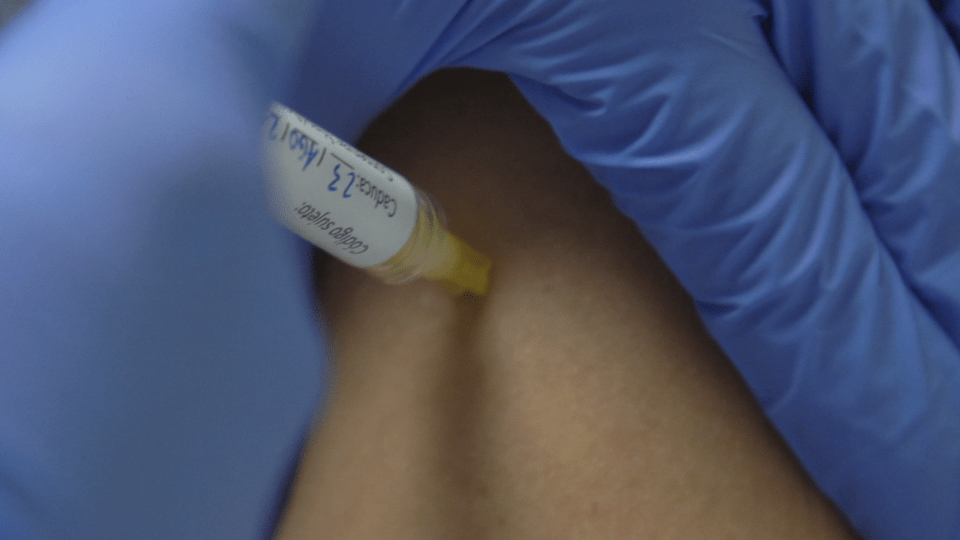
Las primeras personas que participan en la Fase I/IIa de la vacuna COVID-19 HIPRA ya han recibido esta semana la primera dosis. Durante esta semana se han inoculado diferentes participantes, algunos de los cuales han recibido la vacuna en estudio y otros una vacuna ya comercializada. El resto recibirá la vacuna en los próximos días en el Hospital Universitario Clínic de Barcelona y el Hospital Universitario de Girona Doctor Josep Trueta. El estudio está autorizado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y por el Comité de Ética del Hospital Universitario Clínico de Barcelona.
En esta Fase se estudia principalmente la seguridad de la vacuna COVID-19 HIPRA, además de su inmunogenicidad. Se han presentado unas 500 personas de 18 a 39 años, que respondieron a la llamada realizada a mediados de julio. Los equipos implicados en el ensayo clínico realizaron, la semana pasada, la selección de los 30 participantes. Este proceso incluía un cuestionario y un análisis de sangre para garantizar, entre otros, que no hubieran pasado el COVID-19 de manera asintomática y sin ser conscientes de ello. Los seleccionados, tanto hombres como mujeres, son personas sanas, que no han sido infectados por SARS-CoV-2 ni han recibido ninguna dosis de vacuna contra el COVID-19.
Para llevar a cabo el ensayo, los participantes han sido divididos aleatoriamente en grupos, que recibirán diferentes dosis de vacuna. El primer grupo es el que recibe la dosis más baja, y a partir de ahí se van escalando las dosis en los siguientes grupos. De manera aleatoria, una parte de los voluntarios recibirán la vacuna de HIPRA y el resto otra ya comercializada. Ni el voluntario ni el equipo investigador sabrá qué vacuna se ha administrado en cada caso. Un comité independiente de vigilancia hace un seguimiento de todo el ensayo. Uno de los objetivos del ensayo clínico es determinar cuál es la dosis óptima de vacuna, por lo que se hace con un grupo reducido de personas. Al cabo de 21 días recibirán la segunda dosis.
Monitorización de los participantes durante un año
Esta Fase se está haciendo de manera totalmente controlada. Durante todo el ensayo se lleva a cabo una monitorización estrecha a todos los participantes, lo que permitirá hacer los análisis preliminares para poder seguir avanzando en la investigación. Cuando termine el ensayo clínico, se analizarán todos los datos y se extraerán las conclusiones finales. Esta monitorización, que se alarga durante un año, la llevan a cabo los investigadores de los dos centros sanitarios a través de visitas posteriores a la vacunación y visitas de seguimiento.
Si la Fase I/IIa muestra los resultados esperados se espera avanzar a la Fase IIb/III, que deberá ser aprobada por la AEMPS.
Desde los dos hospitales y los equipos de investigación agradecen la gran respuesta recibida por la ciudadanía ante la llamada de voluntarios y se quiere poner en valor esta figura para conseguir que la ciencia avance.
Vacuna COVID-19 HIPRA
La vacuna COVID-19 HIPRA es una vacuna de proteína recombinante que ha sido diseñada para optimizar su seguridad e inducir una potente respuesta inmunitaria neutralizadora del virus del COVID-19. Se conserva entre 2 y 8ºC.
El adyuvante que se utiliza es una emulsión de aceite en agua como la que se ha utilizado desde hace más de 20 años en miles de dosis de vacunas contra la gripe y que ha demostrado ser seguro.
Equipos de investigación
El ensayo clínico de la vacuna de HIPRA lo realizan dos equipos de investigación, con tres investigadores principales.
Por un lado, el Grupo de epidemiología en salud vascular del Institut Català de la Salut (ICS) en Girona, liderado por el Dr. Rafel Ramos, investigador del Institut Universitari d’Investigació en Atenció Primària (IDIAP) Jordi Gol y del Institut d’Investigació Biomèdica de Girona Dr. Josep Trueta (IDIBGI).
Por otra parte, en el Hospital Clínic de Barcelona está trabajando un equipo multidisciplinar de profesionales médicos, de enfermería y de administración de los servicios de Enfermedades infecciosas y del Servicio de Medicina preventiva y epidemiología. Los profesionales que han liderado el estudio son el Dr. Alex Soriano jefe del Servicio de enfermedades infecciosas y jefe del grupo de infecciones nosocomiales del Instituto de Investigaciones biomédicas August Pi i Sunyer (IDIBAPS) y la Dra. Lorna Leal, especialista del servicio de enfermedades infecciosas y miembro del grupo de SIDA y Infección por VIH del IDIBAPS. También hay que destacar la labor realizada por Clara Castán. Al mismo tiempo, se destaca el trabajo que se ha hecho y se está haciendo desde la Unidad de Ensayos Clínicos (Clinical Trials Unit, CTU) del Servicio de Farmacología Clínica (cabe destacar los profesionales de la CTU que han sido colaborando en este proyecto Judit Pich y Joan Albert Arnaiz). LA CTU tiene como objetivo apoyar sobre los aspectos éticos, metodológicos, reguladores y logísticos de los ensayos clínicos con medicamentos o con terapias avanzadas promovidos por investigadores de la institución.
Otra institución involucrada en el ensayo es IrsiCaixa, donde diferentes equipos de investigación participan en el ensayo llevando a cabo una parte importante de la evaluación de la respuesta inmunitaria de la vacuna en estudio, junto con el IDIBAPS.