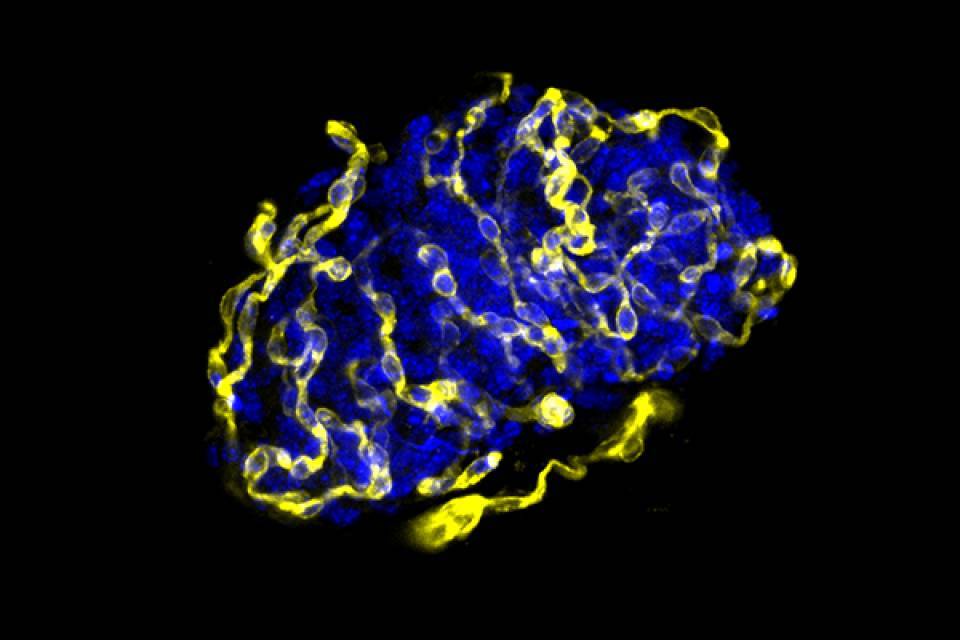
Los investigadores han demostrado, en ratones diabéticos trasplantados con islotes de otros animales o con islotes humanos, que los injertos que no tienen esta proteína experimentan una mayor revascularización, con lo que las células son viables y hay una recuperación de los niveles de azúcar normales y de la tolerancia a la glucosa.
El estudio lo han coordinado Ramon Gomis, jefe del grupo Islotes pancreáticos: biomarcadores y función del IDIBAPS, catedrático de la Facultad de Medicina y Ciencias de la Salud de la Universidad de Barcelona e investigador del CIBERDEM, y Rosa Gasa, investigadora del mismo grupo. El primer autor del trabajo, publicado en la revista Science Translational Medicine, es Hugo Figueiredo, investigador del grupo del IDIBAPS.
Medicina regenerativa para el tratamiento de la diabetes tipo 1
Una de las estrategias utilizadas para el tratamiento de la diabetes tipo 1, basada en la medicina regenerativa, es el trasplante de islotes pancreáticos, unos cúmulos formados por diferentes tipos de células con función endocrina que producen hormonas como la insulina y el glucagón . En la diabetes de tipo 1 las células beta de los islotes, las encargadas de la producción de la insulina, son destruidas de forma selectiva por un proceso autoinmune.
Es por este motivo que el trasplante de islotes puede restablecer la función fisiológica en pacientes con este tipo de diabetes. “Aunque este trasplante se hace en algunos centros, tiene algunas limitaciones, como la administración crónica de inmunosupresores, y se aplica en aquellos casos en los que la enfermedad está mal controlada. Hoy por hoy, sólo se indica en el contexto de un trasplante de riñón y se opta por hacer un trasplante doble vascularizado de riñón – páncreas“, explica Ramon Gomis, coordinador del estudio.
Hay dos retos que se deben superar en el contexto del trasplante de los islotes que están relacionados con la administración crónica de inmunosupresores y con el hecho de que el injerto no se revasculariza de forma adecuada, con lo que los nutrientes y la oxígeno no le llegan. Esta deficiencia provoca que los islotes dejen de ser viables y mueran.
El entorno normal de los islotes está formado por una red densa de capilares responsable del transporte de oxígeno, hormonas y nutrientes hacia los islotes y del transporte de las hormonas generadas hacia el torrente sanguíneo. Para preparar el trasplante, los islotes se separan de su red vascular, con lo que después de ser trasplantados su correcta función y supervivencia dependen de la capacidad de creación de nuevos vasos hacia el sistema vascular del receptor. “El implante de islotes se revasculariza, pero no lo suficientemente rápido. En el artículo nos hemos centrado en conseguir que en el momento del trasplante se creen los vasos suficientes para mantener los islotes en condiciones óptimas y mejorar el éxito de esta estrategia para el tratamiento de la diabetes tipo 1“, apunta Rosa Gasa, coordinadora del trabajo.
Mejorar la revascularización, uno de los retos
En el estudio, publicado en la revista Science Translational Medicine, los investigadores han identificado una diana molecular que permitiría que los islotes pancreáticos trasplantados fueran viables. Se trata de una enzima que se encuentra en todas las células, también a las células beta pancreáticas. Los estudios se han realizado en ratones diabéticos a los que se les han trasplantado islotes de otros ratones o islotes humanos. Los resultados demuestran que la inhibición de esta enzima, una fosfatasa llamada PTP1B, provoca una mayor revascularización, lo que se traduce en una mejor funcionalidad y supervivencia de los islotes. Esto sucede tanto si los islotes trasplantados son otros ratones como si se trata de islotes humanos.
Con su inhibición, se promueve la actividad del factor de crecimiento pro-angiogénico VEGF que facilita la creación de nuevos vasos sanguíneos y, por tanto, hacen que el injerto se revascularice y sea viable. “La regulación de la revascularización la inducen la hipoxia o la falta de nutrientes y la inhibición de la fosfatasa amplifica esta respuesta. En el momento en que desaparece el estímulo, se para la creación de nuevos vasos sanguíneos“, explica Rosa Gasa.
“Este artículo constituye una prueba de concepto que puede llevar a eliminar uno de los motivos que hacen que el trasplante de islotes pancreáticos falle. Existen inhibidores de PTPB1 o de fosfatasas menos específicas y el siguiente paso será probar estos inhibidores en el trasplante de islotes en humanos y valorar su éxito “, concluye Ramón Gomis.
Referencia del estudio:
Targeting pancreatic islet PTP1B improves islet graft revascularization and transplant outcomes
Hugo Figueiredo, Ana Lucia C. Figueroa, Ainhoa Garcia, Rebeca Fernandez-Ruiz, Christophe Broca, Anne Wojtusciszyn, Rita Malpique, Rosa Gasa, Ramon Gomis.
Science Translational Medicine 19 Jun 2019: Vol. 11, Issue 497, eaar6294. DOI: 10.1126/scitranslmed.aar6294