Las mitocondrias son unos orgánulos presentes en las células que tienen diferentes funciones: la más conocida es la generación de energía química para la célula, pero también intervienen en el ciclo y la muerte celular, entre otras. Su mal funcionamiento está relacionado con diversas enfermedades.
"Uno de los objetivos de nuestro grupo es entender los mecanismos mitocondriales implicados en la regulación neuronal del apetito y el peso corporal", explica Marc Claret, responsable del grupo de investigación del IDIBAPS Control neuronal del metabolismo. "Estudios previos que hemos publicado han demostrado que la alteración de las mitocondrias de un determinado grupo de neuronas favorece la aparición de diabetes y obesidad".
En un nuevo trabajo, que ha publicado la revista Cell Metabolism y que ha destacado en la portada, los investigadores se han centrado en entender el papel de las crestas mitocondriales, los repliegues internos de la membrana mitocondrial interna, en una población de neuronas del hipotálamo, denominadas POMC, que son fundamentales para la regulación sistémica del balance energético.

Para ello, han llevado a cabo varios experimentos: "Hemos analizado por microscopía electrónica la forma de las crestas mitocondriales de neuronas POMC en diferentes estados energéticos, hemos generado ratones modificados genéticamente para que las crestas mitocondriales no produjeran la proteína OPA1, que es clave en el mantenimiento y la dinámica de las crestas mitocondriales. Hemos estudiado tanto la fisiología y los mecanismos moleculares de lipólisis (es decir, la movilización de las grasas) del tejido adiposo, como los efectos beneficiosos que la regulación de la entrada de calcio en la mitocondria ejerce sobre el fenotipo de estos ratones ", explica Alicia Garcia, primera firmante del estudio.
Los resultados indican que el estatus energético del organismo, es decir, si está en ayunas o alimentado, si ha recibido una dieta normal o rica en grasas, modula la forma de las crestas mitocondriales en las neuronas POMC. Asimismo, la eliminación de la proteína OPA1 causa obesidad en los ratones. Esta obesidad se produce por un defecto en la activación de la lipólisis en el tejido adiposo durante el ayuno. "Lo que hemos visto es que las alteraciones en la lipólisis y el peso corporal se producen por una desregulación de la entrada de calcio en las mitocondrias de las neuronas POMC, lo que supone una sobrecarga de este ión que impide el correcto funcionamiento del mitocondria y de la neurona ", añade Alicia Garcia. Por su parte, "el bloqueo farmacológico de la entrada de calcio en la mitocondria normaliza las alteraciones observadas en la lipólisis y el peso corporal", concluye Claret.
Este estudio se ha hecho con el apoyo del European Research Council y la Fundación BBVA.
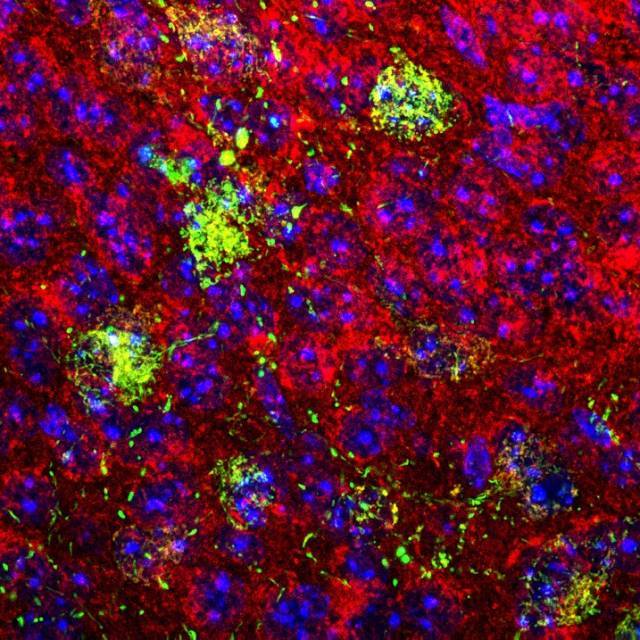
Imagen de microscopia confocal de una sección coronal de cerebro de ratón donde se visualiza en rojo las mitocondrias y, en verde, el sensor de calcio mitocondrial mtGCamP6s expresado en neuronas POMC
Referencia del artículo
Alicia G Gómez-Valadés, Macarena Pozo, Luis Varela, Mehdi Boutagouga Boudjadja, Sara Ramírez, Iñigo Chivite, Elena Eyre, Roberta Haddad-Tóvolli, Arnaud Obri, Maria Milà-Guasch, Jordi Altirriba, Marc Schneeberger, Mónica Imbernón, Angela R Garcia-Rendueles, Pau Gama-Perez, Jonathan Rojo-Ruiz, Bence Rácz, Maria Teresa Alonso, Ramon Gomis, Antonio Zorzano, Giuseppe D'Agostino, Clara V Alvarez, Rubén Nogueiras, Pablo M Garcia-Roves, Tamas L Horvath, Marc Claret
DOI: 10.1016/j.cmet.2021.07.008




