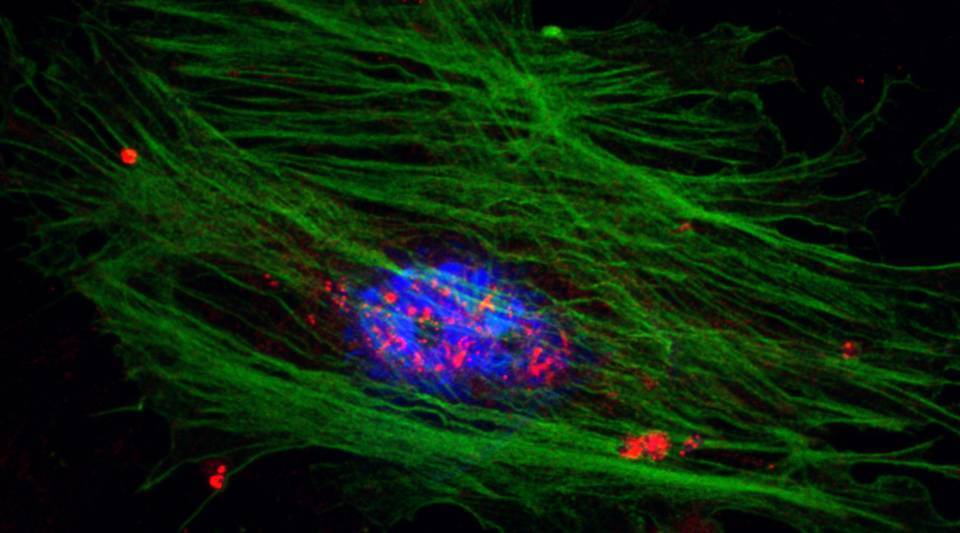
En el estudio, publicado en la revista Gastroenterology, también se describe el mecanismo por el que esto sucede y se proponen estrategias terapéuticas para contrarrestar la activación de las células estrelladas hepáticas.
Mercedes Fernández, jefa del grupo Angiogénesis en la enfermedad hepática del IDIBAPS e investigadora del CIBEREHD, ha coordinado este estudio en el que también han participado investigadores del IDIBELL y del IRB.
Las enfermedades hepáticas crónicas tienen una elevada prevalencia que aumenta de forma constante en todo el mundo. Aun así, el desarrollo de nuevos tratamientos está estancado. El trasplante de hígado representa la única opción terapéutica para la supervivencia a largo plazo de los pacientes con enfermedades hepáticas crónicas, pero la disponibilidad de donantes compatibles es limitada y el procedimiento es costoso. Es por ello por lo que urge encontrar nuevas alternativas de tratamiento.
Después del daño producido en el hígado, una de las respuestas detectables en el sitio del daño es la activación y diferenciación de las células estrelladas hepáticas. Estas células coordinan la respuesta al daño que consiste en crear depósitos ricos en colágeno en la matriz extracelular para mantener la integridad del tejido. “Debe existir un equilibrio en la respuesta, pues un exceso de acumulación de colágeno provoca la fibrosis del tejido hepático. Y eso es precisamente lo que sucede en las enfermedades hepáticas crónicas”, explica Mercedes Fernández.
Esta fibrosis excesiva impide el funcionamiento normal del hígado y actúa como precursora de la cirrosis que puede desembocar en un fallo del órgano o incluso la muerte. “Entender las bases moleculares de la activación de las células hepáticas estrelladas es esencial para definir nuevas dianas para tratamientos antifibróticos y reducir, así, la morbilidad y la mortalidad de los pacientes con enfermedades crónicas del hígado”, señala la investigadora.
Los investigadores analizaron el impacto de una enzima involucrada en los procesos de aportación de energía celular en la activación del comportamiento fibrogénico de las células estrelladas, los mecanismos moleculares asociados y la utilidad de estrategias dirigidas a inhibir su acción como una nueva estrategia antifibrótica.
Los resultados demuestran que cuando las células estrelladas se activan, hay una sobreexpresión de la enzima PFKFB3 y un aumento de la glicólisis, un proceso de aporte energético a las células. “Lo mismo sucede en tejidos de hígados con fibrosis de pacientes y modelos animales”, señala Mercedes Fernández. Inhibir esta enzima en cultivos celulares de células estrelladas reduce su activación y proliferación.
Además, los investigadores han descifrado el mecanismo por el que la enzima PFKFB3 ejerce su actividad en la activación de las células estrelladas. En el mecanismo está involucrada CPEB4, una proteína ya estudiada con anterioridad por el grupo en el contexto de diversas enfermedades hepáticas.
Los hallazgos del estudio revelan el potencial de CPEB4 y PFKFB3 como dianas para el desarrollo de estrategias terapéuticas antifibróticas en un ámbito en el que no se disponen de tratamientos efectivos. “Ya existen inhibidores de PFKFB3 como el 3PO que han demostrado potencial en el tratamiento del cáncer. En nuestro estudio, conseguimos reducir la activación de las células estrelladas”, explica Mercedes Fernández. “Estamos trabajando en el desarrollo de tratamientos para bloquear la actividad de CPEB4, lo que nos permitiría contrarrestar la proyección de la fibrosis sin dañar a las células sanas”, concluye.
Referencia del estudio:
Mejias M, Gallego J, Naranjo-Suarez S, Ramirez M, Pell N, Manzano A, Suñer C, Bartrons R, Mendez R, Fernandez M. Gastroenterology. 2020 Mar 10:S0016-5085(20)30328-0. doi: 10.1053/j.gastro.2020.03.008