El receptor de N-metil-D-aspartato (NMDAR) es un receptor de glutamato, formado por dos tipos de subunidades (GluN1 y GluN2), que se encuentran en las células nerviosas. Este tipo de receptor desempeña un papel clave en la plasticidad sináptica neuronal y en la memoria y se ha relacionado con diversas enfermedades como la esquizofrenia o el Parkinson.
La encefalitis anti-NMDAR es un trastorno neuropsiquiátrico autoinmune severo recientemente identificado que se caracteriza por cambios en el comportamiento, psicosis, disminución de la memoria, convulsiones, inestabilidad y coma. Este trastorno lo causan los anticuerpos de los propios pacientes, que hacen que los receptores NMDA se internalicen en la célula, alterando así su función. Sin embargo, los mecanismos por los que esto sucede no se conocen con detalle.
Los investigadores han estudiado la naturaleza y el cronograma de los procesos que tienen lugar en la sinapsis antes de la internalización y reducción de la cantidad de receptores NMDA de la superficie celular. Para ello, utilizaron la microscopía de localización de una sola molécula, en particular la microscopía de reconstrucción óptica estocástica (STORM), para revelar cómo los receptores de NMDA se distribuyen a lo largo de las dendritas, o prolongaciones, de las neuronas. Es decir, pudieron visualizar la organización a nanoescala de los receptores y cuantificar sus cambios relativos en condiciones patológicas.
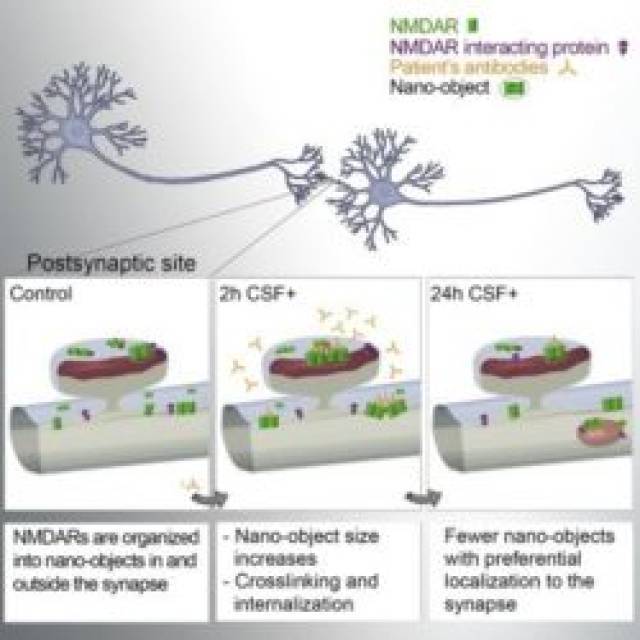
Para comprender mejor los mecanismos, los científicos llevaron a cabo simulaciones por ordenador para modelar el comportamiento de estos receptores a lo largo de las dendritas neuronales en presencia de los anticuerpos de los pacientes. Pudieron reproducir sus resultados experimentales, lo que les permitió extraer los parámetros clave que conducen a las alteraciones inducidas por anticuerpos. Revelaron que la interrupción de las interacciones proteína-proteína, como la que existe entre los receptores NMDA y Ephrin B2, juega un papel importante en la secuencia de eventos que conducen a la patogénesis de la enfermedad.
Los resultados de este estudio aportan información sobre los procesos nanoscópicos mediante los cuales los anticuerpos de los pacientes pueden alterar la función de una proteína específica, abriendo una nueva ventana para comprender los mecanismos moleculares de las enfermedades autoinmunes. Los estudios se centran ahora en determinar si los anticuerpos de los pacientes pueden alterar otras moléculas que interactúan con NMDAR, con el fin de descubrir nuevas potenciales dianas terapéuticas.

