La actividad cerebral se rige por un equilibrio minucioso entre excitación e inhibición neuronal. Así, la activación neuronal se produce por mecanismos de excitación que están estrechamente regulados a través de procesos inhibitorios. Para ciertas funciones, la red neuronal necesita estar sincronizada y ello produce oscilaciones de alta frecuencia que permiten el correcto procesamiento de la información y la ejecución de comportamientos. Esta sincronización depende del equilibrio entre la excitación y la inhibición que se ha visto afectado en un gran número de trastornos que cursan con disfunción cognitiva.
“En el pasado ya habíamos detectado cambios en la arquitectura celular de las neuronas de la corteza cerebralen modelos animales de síndrome de Down. Observamos que la estructura de las neuronas era distinta. Ahora hemos ido un paso más adelante y hemos estudiado la fisiología, es decir, la función de esta corteza cerebral y hemos podido comprobar que esas alteraciones celulares y pequeños cambios en la conectividad inhibitoria se traducen en un déficit de la activación de esta región y en su ritmo y sincronización de la actividad neuronal,” explica la Dra. Mara Dierssen, jefe del grupo de Neurobiología Celular y de Sistemas y co-investigadora principal de este estudio. “Uno de los grandes problemas de la discapacidad intelectual es que no comprendemos cómo las alteraciones que detectamos a nivel celular desembocan en cambios a nivel de los circuitos cerebrales y alteraciones de la función cognitiva. El trabajo que acabamos de publicar explica algunas de estas alteraciones celulares y ofrece por primera vez un estudio in vivo de la fisiología de la corteza cerebral, estructura clave en las funciones ejecutivas como la concentración, el aprendizaje o la resolución de problemas,” añade.
Las científicas se han centrado en uno de los genes relacionados con el síndrome de Down. Mediante experimentos con modelos animales que sobreexpresan el gen candidato, las científicas demostraron que el exceso de este gen provoca cambios muy sutiles en el equilibrio excitación/inhibición y éstos llevan a una reducción notable de la actividad y sincronización de las neuronas excitadoras en la corteza prefrontal. Es decir, que cuando este gen se encuentra sobreexpresado, reduce el nivel de descarga de las neuronas y altera el ritmo en las ondas de alta frecuencia de la corteza cerebral. Es más, observaron que el problema radica en unas neuronas que se encargan de controlar la inhibición. En resumen, si hay menos actividad y existe una desequilibrio en las frecuencias de las ondas cerebrales en síndrome de Down es debido a cambios en la conectividad de las neuronas que deben controlarlas.
El estudio ha combinado experimentos de electrofisiología e histología con un modelo computacional que emula el circuito neuronal de la corteza cerebral de forma virtual. “Hemos identificado alteraciones anatómicas y funcionales, y a través de un modelo computacional hemos demostrado cómo dichos déficits pueden explicar las observaciones experimentales” comenta la Dra. Sánchez Vives, jefe del equipo de Neurociencia de Sistemas y co-investigadora principal del estudio. “Gracias al modelo computacional hemos podido comprender todo el engranaje y realizar predicciones sobre el funcionamiento de la corteza cerebral en esta patología y sobre la evaluación del impacto en la función cognitiva de las alteraciones detectadas” concluye la investigadora.
En este trabajo, cuyos primeros autores son Marcel Ruiz-Mejias del IDIBAPS y María Martínez de Lagrán del CRG, también han participado investigadores de la UniversitatPompeuFabra, Universidad Pablo de Olavide y del Instituto Superior de Sanidad de Roma.
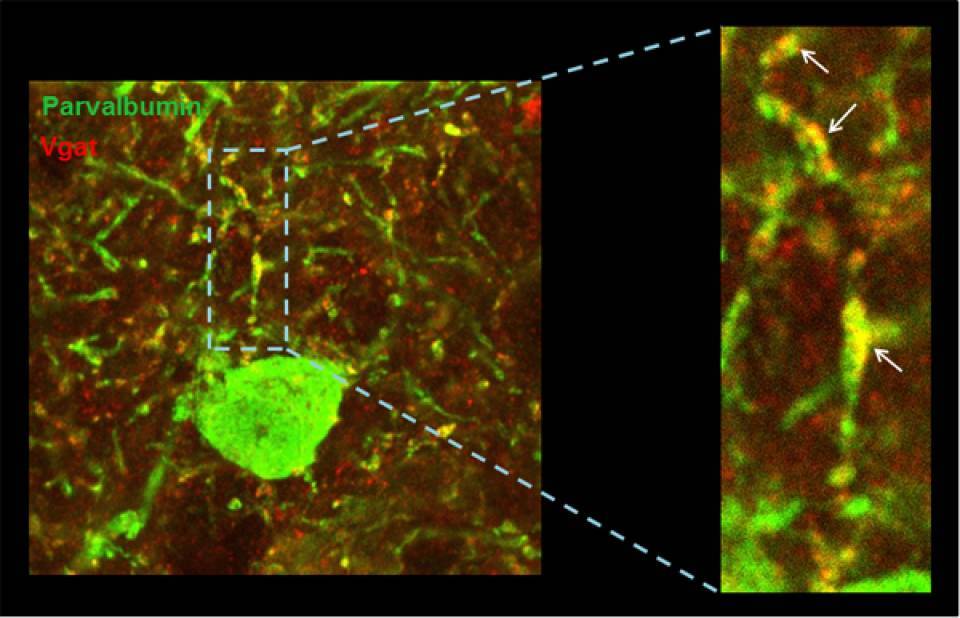
Pie de foto: La actividad de la neurona inhibitoria (verde) es controlada por los contactos de tipo inhibitorio (rojo) que recibe. Este control se ha visto afectado en la corteza cerebral del modelo de ratón de síndrome de Down.
Referencia del artículo:
Ruiz-Mejias M, Martinez de Lagran M, Mattia M, Castano-Prat P, Perez-Mendez L, Ciria-Suarez L, Gener T, Sancristobal B, García-Ojalvo J, Gruart A, Delgado-García JM, Sanchez-Vives MV, Dierssen M.
J Neurosci. 2016 Mar 30;36(13):3648-59. doi: 10.1523/JNEUROSCI.2517-15.2016.