Las grasas son indispensables para la vida, pero muy tóxicas en exceso. En todas las células encontramos cuerpos lipídicos (CL), unos orgánulos que almacenan el exceso de ácidos grasos que llega a la célula para reducir su toxicidad y poder suministrarlos cuando hay un requerimiento de energía. Aunque su función está bien descrita en los adipocitos, las células del organismo especializadas en la acumulación de grasa, poco se sabe sobre la función de los CL en el resto de células y el mecanismo por el que interactúan con otros orgánulos celulares. Conocer estos mecanismos sería de gran importancia dado que una acumulación excesiva de CL es la causa de enfermedades asociadas con la obesidad, como la diabetes tipo II, y de la aterosclerosis, el síndrome metabólico o el hígado graso.
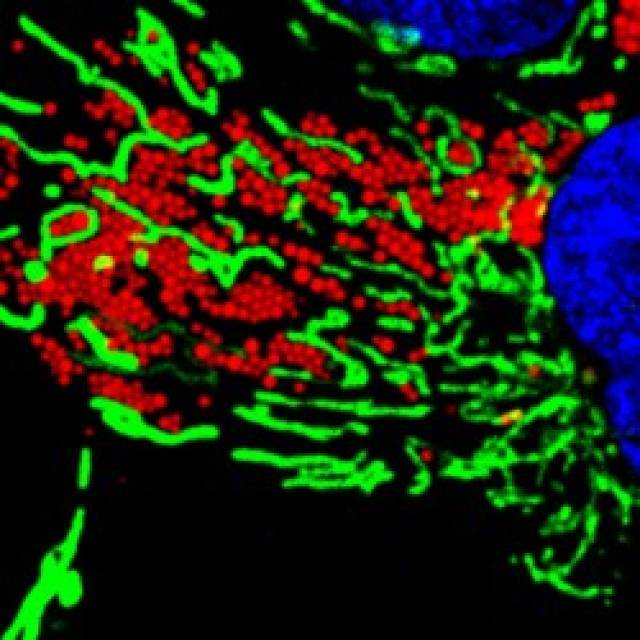
Otra de las novedades de este trabajo es que, para que todo esto suceda, se necesita la activación de una enzima conocida como AMPK (proteína quinasa activada por AMP), que es un sensor de energía celular que ayuda en el balance energético y el consumo de calorías. Los investigadores han demostrado que la AMPK actúa de forma simultánea aumentando la movilidad de los CL, reorganizando la red de microtúbulos y activando a las mitocondrias, tanto en condiciones normales como en ayuno
Muchas enfermedades tienen su origen en una deficiencia en los mecanismos bioenergéticos de las células y la acumulación de CL en diferentes tejidos está correlacionada con diferentes patologías de gran prevalencia. Este artículo demuestra cuál es el mecanismo por el que se movilizan los CL para la producción de energía, tanto en condiciones en las que faltan los nutrientes como en condiciones normales. Con este descubrimiento se podrá profundizar en el conocimiento de las causas y en el tratamiento de enfermedades como la diabetes o la aterosclerosis. "Con la administración de un fármaco como la Metformina, uno de los más utilizados en el tratamiento de la Diabetes de tipo II, se desencadenan todos los procesos que movilizan los CL, quemando las grasas y doblando la eficiencia en la producción de energía ", explica el Dr. Albert Pol, coordinador del estudio.
Referencia del artículo:
Albert Herms, Marta Bosch, Babu J.N. Reddy, Nicole L. Schieber, Alba Fajardo, Celia Rupérez, Andrea Fernández-Vidal, Charles Ferguson, Carles Rentero, Francesc Tebar, Carlos Enrich, Robert G. Parton, Steven P. Gross, Albert Pol
Nature Communications 6, Article number: 7176 doi:10.1038/ncomms8176

