Gairebé el 30% de la població espanyola pateix alteracions en el metabolisme de la glucosa, cosa que pot comportar problemes greus de salut i complicacions com la diabetis. “La diabetis és un mal silent. Sovint no es dona molta importància al fet de tenir la glucosa alta, ja que no produeix cap símptoma. Però els seus efectes s’acumulen durant molt temps i augmenten el risc de patir malalties cardiovasculars greus com infarts de miocardi o ictus, i d’altres com pèrdua de la visió per afectació de la retina, danys als nervis i a les extremitats, o insuficiència renal que pot acabar en diàlisi i transplantament de ronyó”, explica Joan-Marc Servitja, investigador del grup IDIBAPS Patogènia i prevenció de la diabetis, dirigit per Anna Novials.
Les dades indiquen que, a Espanya, quatre milions i mig de persones pateixen diabetis, és a dir, quasi un 14% de la població. “No obstant això, la meitat no ho saben. És el que coneixem com la diabetis desconeguda”, assenyala Novials. “Tot i la rellevància d’aquestes xifres, els diners destinats a la recerca són inferiors als que reben altres malalties com el càncer, l’Alzheimer, el Parkinson o l’obesitat, encara que totes elles tenen una estreta relació amb la diabetis. Això, ens preocupa als investigadors, que lluitem per visibilitzar la malaltia i per educar a la societat sobre la seva importància”.
Un nom, diverses malalties
La paraula diabetis no fa referència a una única malaltia, sinó que engloba diversos trastorns.
La diabetis tipus 1 és una malaltia autoimmunitària que es caracteritza per un augment dels nivells de glucosa a la sang, perquè el propi sistema immunitari de l'organisme ataca i destrueix les cèl·lules del pàncrees que generen la insulina.
La diabetis tipus 2 també es caracteritza per un augment de la concentració de glucosa a la sang. En aquest cas, la causa és la incapacitat del cos de produir o de poder utilitzar de manera adequada la insulina pròpia. S'inicia en adults, d'aquí el nom popular de diabetis de la gent gran. Aquest tipus de diabetis s’associa a l’obesitat i el sedentarisme.
“El 90% dels casos de diabetis són de tipus 2. La diabetis de tipus 1 és la segona més important en prevalença, però també cal destacar la diabetis gestacional i les diabetis monogèniques o de causa genètica”, comenta Servitja. “De fet, cada vegada es controla més la diabetis gestacional, ja que és una mena de preavís. Si al llarg dels anys la mare ha patit sobrepès o obesitat, augmenten les possibilitats que aparegui la diabetis tipus 2”.
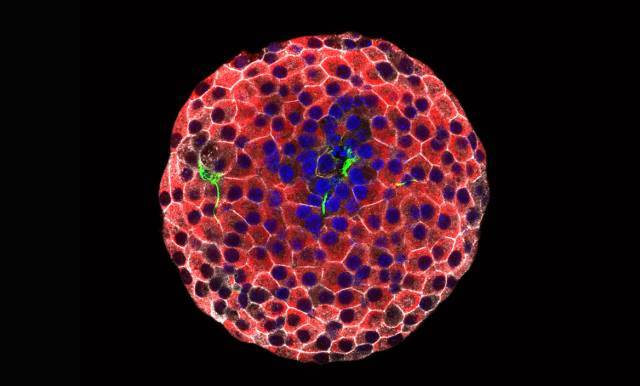
Imatge d'immunofluorescència d'un illot pancreàtic. S'observen cèl·lules beta íntegres (vermell), cèl·lules beta destruides (verd) i els seus nuclis (blau). [Júlia Rodríguez]
És possible restaurar la producció d’insulina?
La recerca en diabetis tipus 1 se centra, principalment, en esbrinar per què el sistema immunitari reacciona contra les cèl·lules beta del pàncrees i en com aturar aquest atac, així com en desenvolupar teràpies cel·lulars que permetin obtenir cèl·lules beta funcionals per a trasplantar-les als pacients. La diabetis tipus 2 és una malaltia multifactorial, que requereix abordar des de la genètica als mecanismes metabòlics i d’inflamació per obtenir la imatge completa i entendre què és el que passa. A més, la dieta i l’estil de vida també juguen un paper important en el desenvolupament de la malaltia. Per això, es treballa en línies de prevenció i educació de la població.
Actualment, no disposem d’una cura eficaç per a la diabetis. “L’administració d’insulina permet cronificar la diabetis, viure amb la malaltia, però no restaura la funció del pàncrees, només la substitueix”, puntualitza Rosa Gasa, investigadora del grup IDIBAPS Recerca translacional en diabetis, lípids i obesitat, liderat per Josep Vidal.
Tant en la diabetis tipus 1 com en la tipus 2 la producció d’insulina s’altera. No obstant, en la primera, s’observa una manca d’insulina des de l’inici de la malaltia, mentre que en els primers estadis de la segona hi ha un excés, que finalment es torna en dèficit. “Això s’explica pel que passa a les cèl·lules beta del pàncrees en cadascun d’aquests dos tipus de diabetis”, comenta Gasa. “Les cèl·lules beta, localitzades als illots pancreàtics, són les encarregades de produir i secretar la insulina. En la diabetis tipus 1 la reacció autoimmunitària destrueix quasi totalment aquestes cèl·lules. En canvi, en la diabetis tipus 2, les cèl·lules beta produeixen insulina, però els teixits es tornen resistents i no responen a l’hormona. Això provoca que l’illot pancreàtic n’augmenti la secreció. No obstant això, a la llarga, aquest sobreesforç causa la disfunció del teixit”.
L’equip de Vidal i Gasa investiga com regenerar les cèl·lules beta pancreàtiques. En concret, busca factors que permetin expandir les poques cèl·lules que queden. “Fins i tot en pàncrees de pacients amb diabetis tipus 1 analitzats post-mortem s’han trobat cèl·lules beta. Això ens indica que d’alguna manera, malgrat la seva destrucció, el teixit intenta regenerar-se”. L’expansió de les cèl·lules beta es produeix durant el primer any de vida en els humans i durant el període de lactància en els ratolins. L’estudi d’aquest període neonatal en rosegadors ha permès al grup Vidal-Gasa identificar una proteïna secretada pel teixit ossi, el factor Wisp1, que podria ser clau pel desenvolupament del pàncrees. “Aquesta molècula també augmenta en infants i disminueix en persones adultes, quan s’atura el creixement de l’esquelet. És probable que hi hagi altres factors que també participen en l’expansió de les cèl·lules beta. Trobar-los pot suposar un avenç important en la regeneració del teixit pancreàtic que queda”.
En paral·lel, l’equip de Vidal i Gasa treballa en una línia de recerca encaminada a la creació de cèl·lules beta a partir de cèl·lules de la pell. “El procés consisteix en agafar cèl·lules diferenciades, com els fibroblasts que hi ha a la dermis i reprogramar-les de forma directa perquè expressin els gens d’un altre tipus cel·lular diferent”, explica Gasa. “Avui dia, només introduint cinc factors de transcripció, unes proteïnes que s’uneixen a l’ADN i regulen l’expressió dels gens, podem reprogramar fibroblasts perquè produeixin i alliberin insulina humana en resposta a l’augment de glucosa en sang”. En ratolins, aquesta secreció d’insulina s’observa fins 30 dies després del trasplantament. “Això ens indica que durant tot aquest període, la reprogramació es manté i les cèl·lules no moren”.
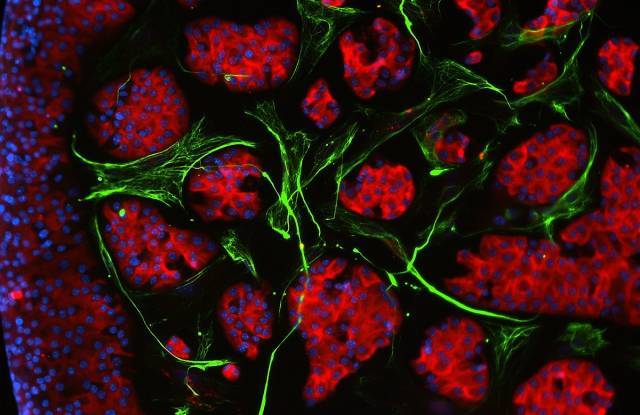
Imatge d'immunofluorescència de cèl·lules d'illots pancreàtics en cultiu(vermell), envoltades de fibroblasts (verd). Els nuclis cel·lulars s'observen tenyits de blau. [Juan Moreno]
L’avantatge d’aquest mètode és que es poden fer trasplantaments a partir d’una mostra molt petita de pell del mateix individu, fet que redueix el risc de rebuig. “Trasplantar un pàncrees sencer és una operació molt complexa, que es realitza només quan no hi ha una altra alternativa. Una altra opció és la implantació d’illots pancreàtics de donants. El problema és que el procés d’aïllament es realitza post-mortem, és molt poc eficient i per cada pacient es necessiten entre dos i tres donants. A més, cal administrar un tractament amb immuno-supressors de per vida. Finalment, en casos de diabetis tipus 1, tot i que durant el primer any el 80% dels trasplantats pot prescindir de les injeccions d’insulina, al cap de cinc anys gran part de les cèl·lules implantades han mort i es requereix un nou trasplantament. Així que no és una cura viable a llarg termini”, exposa la investigadora.
Protegir les cèl·lules beta
Joan-Marc Servitja coincideix a destacar el potencial terapèutic dels trasplantaments. “No obstant això, la qüestió és que si no aconseguim frenar la destrucció de les cèl·lules ens trobarem de nou davant d’un tractament que cronifica la malaltia, però no la cura, ja que constantment haurem de reposar-les”. Per protegir les cèl·lules beta, l’equip de Novials i Servitja ha avaluat l’ús de molècules amb propietats antiinflamatòries, com l’alfa-1 antitripsina. “És un dels pocs projectes que tenim en diabetis tipus 1, perquè la nostra investigació se centra en la diabetis tipus 2, però vàrem obtenir resultats prometedors. Aquests compostos inhibeixen l’acció de les citocines secretades pel sistema immunitari i, per tant, l’atac contra les cèl·lules beta. A més, provoquen molt pocs efectes secundaris”.
“Esperem avançar aquests estudis en pacients”, declara Novials. “Això no obstant, sovint intervenim en etapes molt tardanes de la malaltia, fet que dificulta la protecció i regeneració del pàncrees. Per aquesta raó, una de les nostres principals línies de recerca són els biomarcadors. Molècules que ens permetin detectar persones pre-diabètiques. De fet, hem identificat petites molècules d’ARN, o micro-ARNs, específiques, en una població amb nivells lleugerament elevats de glucosa en sang, però que encara no ha desenvolupat diabetis tipus 2”.
L’estudi d’aquests micro-ARNs, que circulen per la sang dins d’unes vesícules anomenades exosomes, posa en relleu un altre aspecte de la diabetis: la seva complexitat. Tot i que el pàncrees centra bona part de la investigació, el cert és que en el desenvolupament de la malaltia intervenen altres òrgans i teixits, com el fetge, el múscul, el teixit adipós o el cervell. La comunicació entre ells podria explicar el trastorn metabòlic que caracteritza la diabetis. “El pàncrees i el cervell tenen molt en comú”, assenyala Servitja. “En la diabetis tipus 2, es formen dipòsits d’un pèptid, anomenat amilina, al teixit pancreàtic. És un procés molt semblant al que té lloc en el cas de la malaltia d’Alzheimer, on els agregats del pèptid amiloide beta s’acumulen a les neurones i n’ocasionen la mort”, continua Novials. La diabetis i l’Alzheimer també comparteixen una possible diana terapèutica, la proteïna BACE2, com han demostrat els investigadors en un article publicat recentment.

Imatge obtinguda per microscopia electrònica d'exosomes, vesícules extracel·lulars que contenen proteïnes, així com molècules d'ADN i ARN, i les transporten pel torrent sanguini. [Vicent Ribas]
En condicions no patològiques, l’amilina se secreta conjuntament amb la insulina, però per raons que encara es desconeixen, es plega malament i s’acumula, fet que provoca la destrucció de les cèl·lules beta. “El nostre model de diabetis de tipus 2 són ratolins que sobreexpressen l'amilina. A més, els engreixem perquè les seves característiques siguin més semblants a les dels pacients. Aquests animals ens han permès trobar dianes terapèutiques per recuperar la funció de les cèl·lules beta”, diu Servitja.
Una altra línia d’intervenció que permet millorar la diabetis és l’exercici. “L’estil de vida és molt important. En el cas de la diabetis tipus 2, el nostre grup ha vist que l’exercici millora el metabolisme i normalitza els nivells de micro-ARNs que contribueixen a l’estrès del pàncrees. No obstant això, cal informar els pacients sobre la pauta que més els convé per la seva malaltia. Per exemple, en persones amb diabetis tipus 1, sessions llargues i prolongades d’exercici poden provocar hipoglucèmies, baixades de glucosa considerables. En canvi, hem demostrat que entrenaments intervàl·lics, curts i d’alta intensitat com el HITT, comporten un risc menor de provocar hipoglucèmies”, puntualitza Novials.
“El més probable és que la cura de la diabetis requereixi l’ús de la medicina personalitzada, adaptada a cada pacient, i les teràpies combinades, que protegeixin alhora que regenerin el teixit. I per tal d’aconseguir aquesta fita, la recerca multidisciplinària, on participin investigadors de diferents camps, és essencial”, conclou Gasa.
Aquest contingut s’ha elaborat gràcies al suport de la Fundación Española para la Ciencia y la Tecnología (FECYT).




