La recerca està dirigida per Albert Giralt, investigador Ramón y Cajal de la UB, i també la signen els experts Jordi Alberch, Laura López Molina, Anna Sancho Balsells, Ana López i Sílvia Ginés, de la Facultat de Medicina i Ciències de la Salut i de l’Institut de Neurociències, i membres de l’Institut d'Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS) i del Centre d’Investigació Biomèdica en Xarxa sobre Malalties Neurodegeneratives (CIBERNED). Així mateix, participen en el treball José M. Delgado García i Agnès Gruart, de la Universitat Pablo de Olavide, i altres experts de l’INSERM (França) i de l’Institut du Fer à Moulin (França).
Una estratègia prometedora amb reptes importants
La malaltia d'Alzheimer és la forma més comuna de demència en la població. La neurodegeneració en els pacients amb aquesta malaltia produeix un deteriorament de la memòria i altres habilitats cognitives, sovint combinades amb símptomes com alteracions de l'estat d'ànim i canvis de personalitat. Una de les teràpies més prometedores contra l’Alzheimer és l'ús de factors neurotròfics, una família de proteïnes que afavoreix la supervivència de les neurones, com ara el factor neurotròfic derivat del cervell (BDNF, de l’anglès brain-derived neurotrophic factor). L’administració del BDNF planteja reptes importants, com la manca de control sobre el lliurament, que no permet dirigir el BDNF específicament al teixit malalt ni lliurar-ne els nivells adequats, sobretot tenint en compte que els nivells massa alts poden ser neurotòxics.
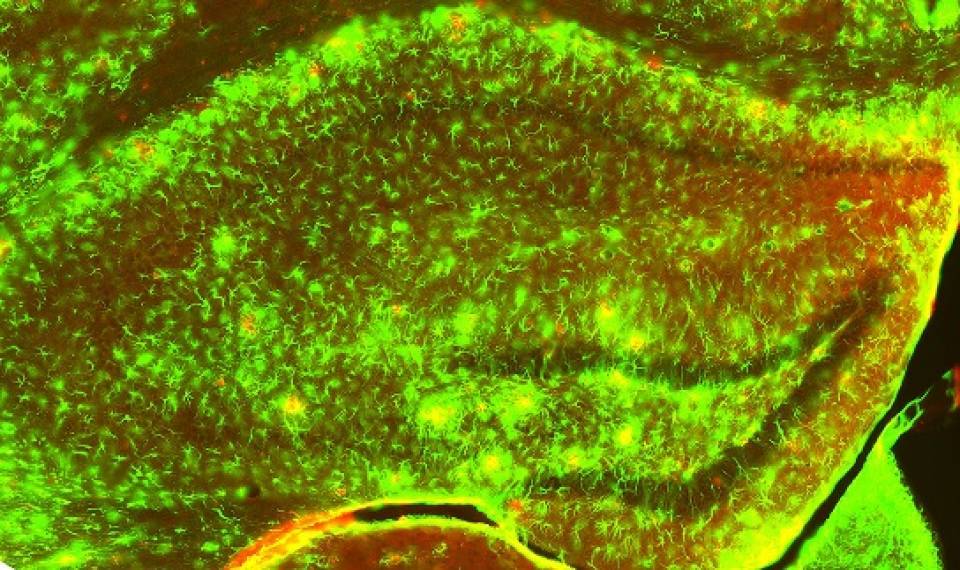
En aquesta recerca els investigadors han estudiat els BDNF generats pels astròcits, un tipus de cèl•lules de glia de forma estrellada que es troben al cervell i a la medul•la espinal. Els astròcits es veuen afectats per un dels processos de neuroinflamació més coneguts durant l’Alzheimer, l’astrogliosi, en què la proteïna més alterada per excel·lència és la GFAP. En aquest context, els investigadors van dissenyar un experiment en què uns ratolins modificats genèticament pateixen Alzheimer i també produeixen BDNF en funció dels nivells de GFAP. «Aquest disseny ens va permetre que, des del moment en què hi ha neuroinflamació i patologia, els astròcits generen BDNF a les zones més afectades del cervell malalt. Per tant, les mateixes reaccions endògenes del cervell regularien aquesta administració de BDNF segons la severitat de la malaltia», explica Albert Giralt, que és membre del Grup de Recerca Consolidat de Fisiopatologia de Malalties Neurodegeneratives de la UB.
Efectes en la plasticitat i la formació de neurones
L’estudi mostra que aquest mètode restaura la producció i el lliurament dels factors neutròfics en el teixit neuronal malalt quan comença la patologia, de manera que el BDNF generat pels astròcits regula la formació de neurones en les mostres de cultius neuronals in vitro i també té efectes cognitius en els models de ratolí transgènics. «Aquests resultats demostren per primera vegada que els astròcits també produeixen BDNF, fins ara considerat únicament de tipus neuronal, i que tenen els mecanismes moleculars necessaris per alliberar-lo en zones del teixit nerviós malalt on es requereix activitat a favor de la supervivència neuronal», explica Albert Giralt.
Els investigadors també assenyalen que «l’originalitat del disseny permet que siguin les mateixes cèl•lules astroglials les que "decideixin" quan, on i en quina quantitat faria falta produir i administrar el BDNF en els teixits cerebrals alterats». Així doncs, «les característiques del pacient marcarien de forma endògena i autoregulada la dosi i les altres dinàmiques terapèutiques necessàries per a un tractament personalitzat».
Tot i que l’ús en humans d’aquesta teràpia encara està molt lluny, els investigadors apunten l'ús d'astròcits a partir de cèl•lules mare pluripotents induïdes com una prometedora estratègia terapèutica que s’ha d’explorar. «Una possibilitat seria que en un futur es poguessin derivar cèl·lules mare induïdes de la pell dels mateixos pacients, i posteriorment modificar-les genèticament in vitro per expressar BDNF sota el promotor GFAP. Finalment, el darrer pas podria ser diferenciar-les i trasplantar-les en les regions més alterades en pacients per promoure la supervivència i el funcionament adequat de les neurones existents», detalla Albert Giralt.
Viabilitat en altres malalties neurodegeneratives
El fet que aquesta recerca aprofiti els processos de neuroinflamació obre la possibilitat que també es pugui explorar en altres malalties neurodegeneratives. «El nostre objectiu és, d’una banda, aconseguir que aquesta aproximació terapèutica sigui plausible per al seu ús en humans, i de l'altra, proposar aproximacions similars en malalties neurodegeneratives en què la neuroinflamació és un símptoma principal», conclou l’investigador.
Article de referència:
Benoit de Pins, Carmen Cifuentes-Díaz, Amel Thamila Farah, Laura López-Molina, Enrica Montalban, Anna Sancho-Balsells, Ana López, Sílvia Ginés, José María Delgado-García, Jordi Alberch, Agnès Gruart, Jean-Antoine Girault i Albert Giralt. «Conditional BDNF delivery from astrocytes rescues memory deficits, spine density and synaptic properties in the 5xFAD mouse model of Alzheimer disease». Journal of Neuroscience, gener de 2019. Doi: https://doi.org/10.1523/JNEUROSCI.2121-18.2019
Peu de foto:
En verd es veu marcat el GFAP i, per tant, els astròcits reactius en les zones de patologia, és a dir, on hi ha plaques amiloides (en vermell).