Aquest treball el lidera el Dr. Juan Carlos Izpisúa, Professor d'Expressió Genètica del Salk Institute. També hi han participat, entre altres, el Dr. Josep Maria Campistol, director general i nefròleg de l'Hospital Clínic i investigador de l'IDIBAPS, i científics de la Universidad Católica de Murcia (UCAM) i de la Fundació Pedro Guillén.
La majoria dels sistemes CRISPR / CAS9 funcionen mitjançant la creació de trencaments en la doble cadena d'ADN en les regions del genoma seleccionades per a la seva edició o supressió. Són molts els investigadors que s'oposen a crear tals ruptures en l'ADN dels éssers humans vius. "Encara que molts estudis han demostrat que CRISPR/Cas9 es pot aplicar com una poderosa eina per a la teràpia gènica, hi ha una creixent preocupació per les mutacions no desitjades generades pels trencaments en la doble cadena a través d'aquesta tecnologia", explica Juan Carlos Izpisúa-Belmonte. "Hem pogut donar solució a aquesta preocupació", afegeix.
En el sistema CRISPR/Cas9 original, l'enzim Cas9 s'acobla a ARNs guia que la dirigeixen al lloc correcte en el genoma per crear els trencaments en la doble cadena. Recentment, alguns investigadors han començat a utilitzar una forma "morta" de Cas9 (dCas9), que pot dirigir-se a llocs específics en el genoma, però sense tallar l'ADN. Així, dCas9 s'acobla als dominis d'activació transcripcional, o interruptors moleculars, que activen gens específics. Però la proteïna-dCas9 resultant unida als interruptors és massa gran i voluminosa per cabre en el vehicle que s'utilitza per administrar aquest tipus de teràpies a cèl·lules en organismes vius, els virus adenoassociats (AAV). La manca d'un sistema de lliurament eficient fa que sigui molt difícil utilitzar aquesta eina en aplicacions clíniques.
En l'article publicat a Cell, els investigadors van combinar Cas9/dCas9 amb una gamma de diferents interruptors per trobar una combinació que funcionés fins i tot quan les proteïnes no estaven fusionades entre si. En altres paraules, Cas9 o dCas9 es va empaquetar en un AAV, i els interruptors i l'ARN guia, en un altre. També van optimitzar els ARN guia per assegurar-se que totes les peces acabessin en el lloc desitjat en el genoma, i que el gen diana fos fortament activat.
"Tots els components treballen junts en l'organisme per influir en els gens endògens", explica Hsin-Kai (Ken) Liao, investigador al laboratori de Izpisúa Belmonte i primer autor de l'article. D'aquesta manera, la tecnologia funciona a nivell epigenètic, el que significa que influeix en l'activitat dels gens sense canviar la seqüència d'ADN.
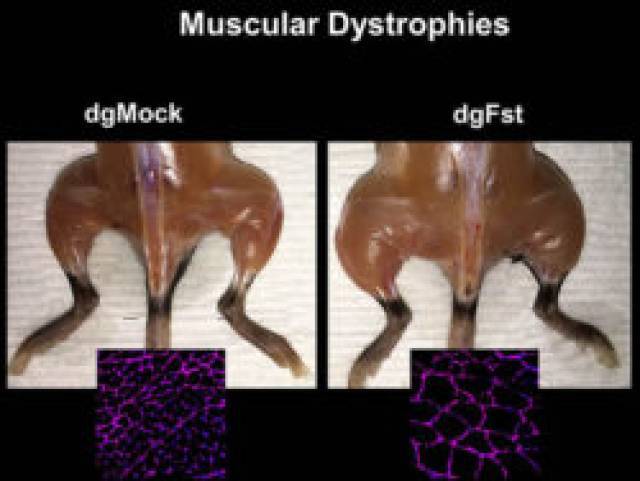
"Quan vam veure els resultats en ratolins, ens emocionem molt", assenyala Fumiyuki Hatanaka, investigador del Salk Institute i coautor de l'article. "Podem induir l'activació de gens i, al mateix temps, veure el canvi fisiològic".
L'equip d'investigadors ara està treballant per millorar l'especificitat d'aquest sistema i aplicar-lo a més tipus de cèl·lules i òrgans per a tractar una gamma més àmplia de malalties humanes, així com per rejovenir òrgans específics i revertir el procés d'envelliment. Es necessiten, però, més proves de seguretat abans de poder utilitzar aquesta tècnica en éssers humans.
“Aquest treball, liderat pel Dr. Izpisúa-Belmonte i el seu equip, obre noves perspectives en el camp de l’edició génica i en la possibilitat de millorar el pronòstic de determinades malalties”, explica el Dr. Josep M. Campistol, que espera que, “aquest nou enfocament algun dia es pugui traslladar a la pràctica clínica i confimi el seu potencial terapèutic”.
Altres investigadors que han participat en l'estudi són Toshikazu Araoka, Pradeep Reddy, Min-Zu Wu, Takayoshi Yamauchi, Masahiro Sakurai, David O'Keefe i Concepción Rodríguez Esteban, del Salk Institute; Yinghui Sui, Cheng-Jang Wu i Li-Fan Lu, de la Universitat de Califòrnia a San Diego; Estrella Núñez, de la Universitat Catòlica de Múrcia i Pedro Guillen, de la Fundació Pedro Guillén.
