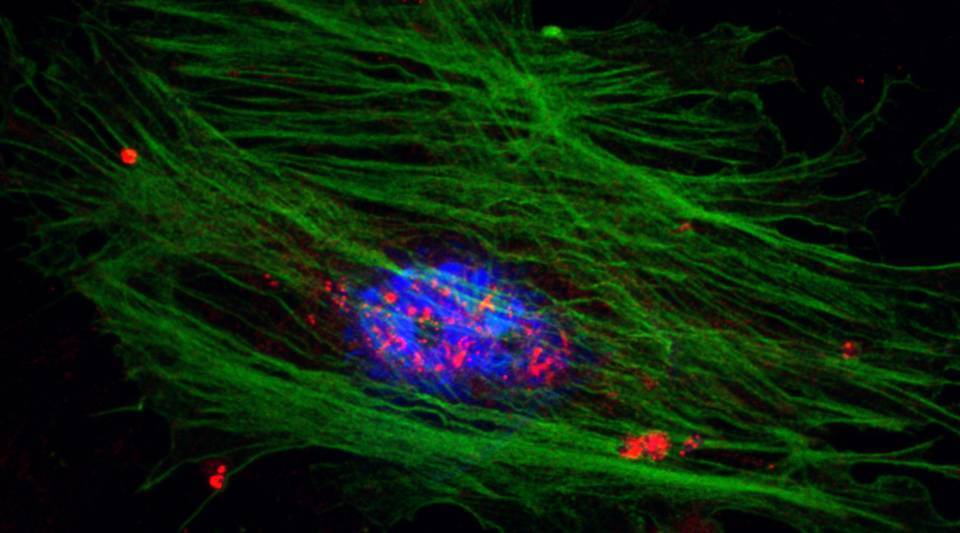
En l'estudi, publicat a la revista Gastroenterology, també es descriu el mecanisme pel qual això succeeix i es proposen estratègies terapèutiques per contrarestar l'activació de les cèl·lules estrellades hepàtiques.
Mercedes Fernández, cap de el grup Angiogènesi en la malaltia hepàtica de l'IDIBAPS i investigadora de l'CIBEREHD, ha coordinat aquest estudi en el qual també han participat investigadors de l'IDIBELL i de l'IRB.
Les malalties hepàtiques cròniques tenen una elevada prevalença que augmenta de forma constant en tot el món. Tot i així, el desenvolupament de nous tractaments està estancat. El trasplantament de fetge representa l'única opció terapèutica per a la supervivència a llarg termini dels pacients amb malalties hepàtiques cròniques, però la disponibilitat de donants compatibles és limitada i el procediment és costós. És per això pel que urgeix trobar noves alternatives de tractament.
Després de el dany produït en el fetge, una de les respostes detectables en el lloc de el dany és l'activació i diferenciació de les cèl·lules estrellades hepàtiques. Aquestes cèl·lules coordinen la resposta a el dany que consisteix en la creació de dipòsits rics en col·lagen en la matriu extracel·lular per mantenir la integritat del teixit. "Hi ha d'haver un equilibri en la resposta, ja que un excés d'acumulació de col·lagen provoca la fibrosi de el teixit hepàtic. I això és precisament el que succeeix en les malalties hepàtiques cròniques", explica Mercedes Fernández.
Aquesta fibrosi excessiva impedeix el funcionament normal del fetge i actua com a precursora de la cirrosi que pot desembocar en una fallida de l'òrgan o fins i tot la mort. "Entendre les bases moleculars de l'activació de les cèl·lules hepàtiques estrellades és essencial per definir noves dianes per a tractaments antifibròtics i reduir, així, la morbiditat i la mortalitat dels pacients amb malalties cròniques de fetge", assenyala la investigadora.
Els investigadors van analitzar l'impacte d'un enzim involucrat en els processos d'aportació d'energia cel·lular en l'activació del comportament fibrogènic de les cèl·lules estrellades, els mecanismes moleculars associats i la utilitat d'estratègies dirigides a inhibir la seva acció com una nova estratègia antifibròtica.
Els resultats demostren que quan les cèl·lules estrellades s'activen, hi ha una sobreexpressió de l'enzim PFKFB3 i un augment de la glicòlisi, un procés d'aportació energètica a les cèl·lules. "El mateix succeeix en teixits de fetges amb fibrosi de pacients i models animals", assenyala Mercedes Fernández. Inhibir aquest enzim en cultius cel·lulars de cèl·lules estrellades redueix la seva activació i proliferació.
A més, els investigadors han desxifrat el mecanisme pel qual l'enzim PFKFB3 exerceix la seva activitat en l'activació de les cèl·lules estrellades. En el mecanisme està involucrada CPEB4, una proteïna ja estudiada amb anterioritat pel grup en el context de diverses malalties hepàtiques.
Les troballes de l'estudi revelen el potencial de CPEB4 i PFKFB3 com a dianes per al desenvolupament d'estratègies terapèutiques antifibròtiques en un àmbit en el qual no es disposen de tractaments efectius. "Ja hi ha inhibidors de PFKFB3 com el 3PO que han demostrat potencial en el tractament de el càncer. En el nostre estudi, vam aconseguir reduir l'activació de les cèl·lules estrellades", explica Mercedes Fernández. "Estem treballant en el desenvolupament de tractaments per bloquejar l'activitat de CPEB4, el que ens permetria contrarestar la projecció de la fibrosi sense fer mal a les cèl·lules sanes", conclou.
Referència de l'estudi:
Mejias M, Gallego J, Naranjo-Suarez S, Ramirez M, Pell N, Manzano A, Suñer C, Bartrons R, Mendez R, Fernandez M. Gastroenterology. 2020 Mar 10:S0016-5085(20)30328-0. doi: 10.1053/j.gastro.2020.03.008