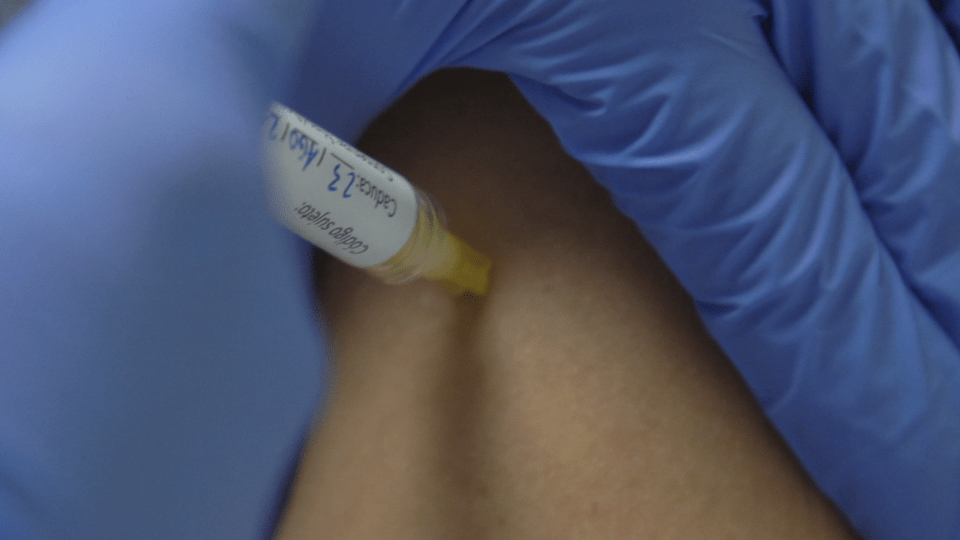
Les primeres persones que participen en la fase I/IIa de la vacuna contra la COVID-19 HIPRA ja han rebut aquesta setmana la primera dosi. Durant aquesta setmana s’han inoculat diferents participants, alguns dels quals han rebut la vacuna en estudi i d’altres una vacuna ja comercialitzada. La resta rebrà la vacuna en els propers dies a l’Hospital Universitari Clínic de Barcelona i a l’Hospital Universitari de Girona Doctor Josep Trueta. L’estudi està autoritzat per l'Agència Espanyola de Medicaments i Productes Sanitaris (AEMPS) i pel Comitè d’Ètica de l’Hospital Universitari Clínic de Barcelona.
En aquesta fase s’estudia principalment la seguretat de la vacuna contra la COVID-19 HIPRA, a més de la seva immunogenicitat. S’han presentat unes 500 persones de 18 a 39 anys, que van respondre a la crida feta a mitjans de juliol. Els equips implicats en l’assaig clínic van realitzar, la setmana passada, la selecció dels 30 participants. Aquest procés incloïa un qüestionari i una anàlisi de sang per garantir, entre d’altres aspectes, que no haguessin passat la COVID-19 de manera asimptomàtica i sense ser-ne conscients. Els seleccionats, tant homes com dones, són persones sanes que no han estat infectades pel SARS-CoV-2 ni han rebut cap dosi de vacuna contra la COVID-19.
Per dur a terme l’assaig, els participants han estat dividits aleatòriament en grups, que rebran diferents dosis de vacuna. El primer grup és el que rep la dosi més baixa i, a partir d’aquí, es van escalant les dosis en els grups següents. De manera aleatòria, una part dels voluntaris rebran la vacuna d’HIPRA i la resta una altra ja comercialitzada. Ni el voluntari ni l’equip investigador sabrà quina vacuna s’ha administrat en cada cas. Un comitè independent de vigilància fa un seguiment de tot l’assaig. Un dels objectius de l’assaig clínic és determinar quina és la dosi òptima de vacuna, motiu pel qual es fa en un grup reduït de persones. Al cap de 21 dies, rebran la segona dosi.
Monitoratge dels participants durant un any
Aquesta fase s’està fent de manera totalment controlada. Durant tot l’assaig es du a terme un monitoratge estret a tots els participants, fet que permetrà realitzar les anàlisis preliminars per poder continuar avançant en la investigació. Quan acabi l'assaig clínic, s’analitzaran totes les dades i s’extrauran les conclusions finals. Aquest monitoratge, que s’allarga durant un any, el porten a terme els investigadors dels dos centres sanitaris a través de visites posteriors a la vacunació i de visites de seguiment.
Si la fase I/IIa mostra els resultats previstos s’espera avançar a la fase IIb/III, que haurà de ser aprovada per l’AEMPS.
Des dels dos hospitals i els equips de recerca es vol agrair la gran resposta rebuda per la ciutadania davant la crida de voluntaris i es vol posar en valor aquesta figura per aconseguir que la ciència avanci.
Vacuna contra la COVID-19 HIPRA
Es tracta d’una vacuna de proteïna recombinant que ha estat dissenyada per optimitzar la seguretat i induir una potent resposta immunitària neutralitzadora del virus de la COVID-19. Es conserva entre 2 i 8º C.
L’adjuvant que s’usa és una emulsió d’oli en aigua com la que s’ha utilitzat des de fa més de 20 anys en milers de dosis de vacunes contra la grip i que ha demostrat ser segur.
Equips de recerca
L'assaig clínic de la vacuna d’HIPRA el duen a terme dos equips de recerca, amb tres investigadors principals.
D’una banda, el Grup d’Epidemiologia en Salut Vascular de l’Institut Català de la Salut a Girona liderat pel Dr. Rafel Ramos ―investigador de l’Institut Universitari d'Investigació en Atenció Primària (IDIAP) Jordi Gol i de l’Institut d'Investigació Biomèdica de Girona Dr. Josep Trueta (IDIBGI).
D’altra banda, a l’Hospital Clínic de Barcelona hi està treballant un equip multidisciplinar de professionals mèdics, d’infermeria i d’administració dels serveis de Malalties infeccioses i del Servei de Medicina preventiva i epidemiologia. Els professionals que han liderat l’estudi són el Dr. Àlex Soriano cap del Servei de malalties infeccioses i cap del grup d’infeccions nosocomials de l’Institut d’Investigacions biomèdiques August Pi i Sunyer (IDIBAPS) i la Dra. Lorna Leal, especialista del servei de malalties infeccioses i membre del grup de SIDA i Infecció per VIH de l’IDIBAPS. També cal destacar la tasca feta per Clara Castán. Al mateix temps, es destaca la feina que s’ha fet i s’està fent des de la Unitat d'Assajos Clínics (Clinical Trials Unit, CTU) del Servei de Farmacologia Clínica (cal destacar els professionals de la CTU que han estat col·laborant en aquest projecte Judit Pich i Joan Albert Arnaiz). LA CTU té com a objectiu donar suport sobre els aspectes ètics, metodològics, reguladors i logístics dels assajos clínics amb medicaments o amb teràpies avançades promoguts per investigadors de la institució.
Una altra institució involucrada en l’assaig és IrsiCaixa, on diferents equips de recerca participen en l’assaig portant a terme una part important de l’avaluació de la resposta immunitària de la vacuna en estudi, juntament amb l’IDIBAPS.